FDA: Estratégias de mitigação do administrador de ventiladores: Carta aos provedores de assistência médica
A OMS recomenda vacina inovadora contra malária para crianças em risco
La histórica recomendación de la vacuna RTS,S/AS01 puede revitalizar la lucha contra esta enfermedad
La Organización Mundial de la Salud (OMS), basándose en los resultados de un programa experimental en curso con el que se ha vacunado a más de 800 000 niños en Ghana, Kenya y Malawi desde 2019, recomienda la administración generalizada de la vacuna antipalúdica RTS,S/AS01 (vacuna RTS,S) a la población infantil del África Subsahariana y de otras regiones donde la transmisión de Plasmodium falciparum sea moderada o alta.
El Dr. Tedros Adhanom Ghebreyesus, Director General de la OMS, ha señalado: «Nos encontramos ante un momento histórico. La tan esperada vacuna antipalúdica infantil representa un gran salto adelante para la ciencia, la salud de los niños y la lucha contra esta enfermedad. Al añadirla a las herramientas ya disponibles para prevenir el paludismo, podremos salvar la vida de decenas de miles de niños cada año».
El paludismo (o malaria) continúa siendo la primera causa de enfermedad y muerte infantiles en el África Subsahariana y, cada año, se lleva la vida de más de 260 000 niños africanos menores de cinco años.
En los últimos años, la OMS y sus asociados han ido informando de que se ha producido un estancamiento en la lucha contra esta enfermedad letal.
El Dr. Matshidiso Moeti, Director de la Oficina Regional de la OMS para África, señaló: «Durante décadas, el paludismo ha azotado el África Subsahariana, causando un enorme sufrimiento a las personas. Hace mucho tiempo que esperábamos disponer de una vacuna antipalúdica eficaz y, por primera vez, se recomienda el uso generalizado de una vacuna. La recomendación que se hace hoy infunde un rayo de esperanza al continente más afectado por la enfermedad, y esperamos proteger del paludismo a muchos más niños, que podrán crecer con salud hasta la edad adulta».
Recomendación por la OMS relativa a la vacuna antipalúdica RTS,S
Basándose en el dictamen de dos de sus organismos consultivos a nivel mundial, uno en materia de inmunización y otro de paludismo:
En el contexto de la lucha antipalúdica integral, la OMS recomienda administrar la vacuna RTS,S/AS01 para prevenir el paludismo por P. falciparum a los niños de las regiones donde la transmisión sea moderada o alta, según defina la propia OMS. La vacuna RTS,S/AS01 se debe administrar con una pauta de cuatro dosis a los niños a partir de cinco meses de edad para reducir la enfermedad y la carga de morbimortalidad del paludismo.
Resumen de las principales conclusiones tras la administración experimental de la vacuna
La presente recomendación se basa en los datos y los conocimientos adquiridos durante los dos años en que se han desarrollado programas piloto de vacunación en establecimientos de salud infantil de tres países, bajo la dirección de los ministerios de salud de Ghana, Kenya y Malawi, de los que se han extraído las siguientes conclusiones:
- La introducción de la vacuna RTS,S es viable: se ha comprobado que la cobertura vacunal mediante distintas estrategias de inmunización sistemática es viable, mejora la salud y salva vidas. Ello se ha observado en el contexto de la pandemia de COVID-19.
- Se atiende a los desatendidos: la vacuna RTS,S permite acceder a la prevención del paludismo de forma más equitativa:
▪ De acuerdo con los datos del programa piloto, la vacuna se ha administrado, en los tres países, a más de dos terceras partes de los niños que no duermen bajo un mosquitero.
▪ El uso en paralelo de las herramientas disponibles permite ofrecer al menos una intervención preventiva (mosquiteros tratados con insecticidas o la vacuna) al 90% de los niños.
- Buen perfil de tolerabilidad: hasta la fecha se han administrado más de 2,3 millones de dosis en tres países africanos. La vacuna tiene un buen perfil de tolerabilidad.
- No reduce el uso de mosquiteros, la administración de otras vacunas infantiles y el recurso a la atención de salud ante los síntomas de fiebre: en las zonas donde se ha introducido la vacuna no se han observado reducciones en la utilización de mosquiteros tratados con insecticidas, la cobertura de otras vacunas infantiles y la solicitud de asistencia médica en caso de enfermedad febril.
- Efectos marcados de la vacunación infantil en situación real: se ha observado una disminución significativa (del 30%) de los casos graves y mortales de paludismo, incluso en las zonas donde se utilizan de forma generalizada mosquiteros tratados con insecticidas y se ofrece un acceso adecuado al diagnóstico y el tratamiento.
- Alta rentabilidad: de acuerdo con los estudios de modelización, la vacuna resulta rentable en las zonas donde la transmisión del paludismo es moderada o alta.
Los próximos pasos que se deben dar en relación con la vacuna antipalúdica recomendada por la OMS son, por parte del sector de la atención de salud en todo el mundo, la adopción de decisiones que permitan financiar su introducción más amplia y, en cuanto a las instancias decisorias de los países, su inclusión en las estrategias nacionales de lucha antipalúdica.
Financiación
La financiación del programa piloto se ha logrado gracias a una colaboración sin precedentes entre tres de los principales organismos mundiales en esta esfera: Gavi, la Alianza para las Vacunas; el Fondo Mundial de Lucha contra el SIDA, la Tuberculosis y la Malaria; y el Unitaid.
Nota para los redactores:
- La vacuna RTS,S actúa contra Plasmodium falciparum, el más mortífero de los parásitos causantes del paludismo en todo el mundo y el más prevalente en África.
- El Programa de Introducción de la Vacuna Antipalúdica está permitiendo obtener pruebas y adquirir experiencia sobre los efectos y la tolerabilidad de la vacuna RTS,S y sobre la viabilidad de la vacunación en zonas donde se llevan a cabo habitualmente campañas de inmunización.
- La introducción experimental de la vacuna antipalúdica está dirigida por los ministerios de salud de Ghana, Kenya y Malawi.
- El programa piloto se seguirá desarrollando en estos tres países con el fin de conocer las ventajas de añadir una cuarta dosis y de medir los efectos a largo plazo en la mortalidad infantil.
- La OMS coordina el Programa de Introducción de la Vacuna Antipalúdica, con ayuda de asociados nacionales e internacionales como PATH, el Unicef y GSK, que ha donado 10 millones de dosis vacunales para el programa.
- La vacuna antipalúdica RTS,S es el fruto de 30 años de trabajo de GSK en materia de investigación y desarrollo, gracias a una alianza con PATH y al apoyo de una red de centros africanos de investigación.
- La Fundación Bill y Melinda Gates aportó financiación catalítica entre 2011 y 2015, en la última etapa del desarrollo de la vacuna RTS,S.
Anvisa é aceita em programa internacional de inspeções
A Anvisa foi aceita no Programa Internacional de Racionalização de Inspeções de Boas Práticas de Fabricação (BPF) de Insumos Farmacêuticos Ativos (IFAs). Com isso, o Brasil passa a integrar um grupo formado por diversos países que atuam de forma articulada para a realização de inspeções e o compartilhamento de informações.
A comunicação oficial da conclusão exitosa do processo de adesão da Anvisa ao API Cluster (nome do programa) foi feita pela Agência Europeia de Medicamentos (European Medicines Agency – EMA), no dia 17/9.
A adesão como membro do programa fortalece a cooperação já existente entre as agências, com o reconhecimento da Anvisa como participante ativa, contribuindo para o aprimoramento e a racionalização internacional das inspeções de boas práticas de fabricação de insumos farmacêuticos ativos.
Como membro efetivo do API Cluster, será possível maior troca de informação entre os órgãos reguladores, com consequente melhora na capacidade de inspeção dos participantes, permitindo que mais locais sejam monitorados e reduzindo a duplicidade de ações.
Sobre o programa
O programa possui o objetivo de racionalizar as inspeções de BPF para fabricantes internacionais de IFAs, com foco na cooperação e confiança mútua entre os reguladores participantes, facilitando a comunicação e a troca de informações.
A iniciativa facilita a troca de dados sobre o cronograma de inspeções, bem como o desfecho destas atividades, incluindo a organização de vistorias conjuntas entre os membros em sítios fabris de interesse comum.
Além do Brasil, as autoridades membros participantes são as seguintes:
- França (Agence Nationale de Sécurité du Médicament et des Produits de Santé – ANSM).
- Dinamarca (The Danish Medicines Agency – DKMA).
- Irlanda (Health Products Regulatory Authority – HPRA).
- Itália (Agenzia Italiana del Farmaco – AIFA).
- Reino Unido (Medicines & Healthcare Products Regulatory Agency – MHRA).
- The European Directorate of the Quality of Medicines and Healthcare - EDQM.
- Estados Unidos (Food and Drug Administration – FDA).
- Australia (Therapeutic Goods Administration – TGA).
- Canadá (Health Canada).
Convergência
A entrada da Anvisa no programa é mais um passo nos esforços do órgão para a convergência regulatória internacional, assim como a recente admissão no Esquema de Cooperação de Inspeção Farmacêutica (Pharmaceutical Inspection Co-operation Scheme – PIC/S) e a racionalização da força de trabalho em busca de respostas ágeis à sociedade, sem prejuízo da qualidade da avaliação técnica. A admissão mostra também o fortalecimento e o reconhecimento internacional do trabalho da Agência na área de inspeções sanitárias.
Extensão de prazo para 15 de outubro de 2021
Call for expression of interest to contribute to the value chain and supply of reagents for the sustainable manufacturing of a COVID-19 and other mRNA vaccines in the Americas [Deadline extension from 17 September to 15 October 2021]
For the successful establishment of mRNA vaccine manufacturing capacity globally, the World Health Organization (WHO) has launched a new initiative to support transfer of technology to produce mRNA vaccines in low- and middle-income countries (LMICs) (1). The initiative will ensure that all WHO regions will be able to produce vaccines as essential preparedness measure against future infectious threats.
Under this initiative, WHO and the Pan American Health Organization (PAHO) are working together to establish mRNA vaccine manufacturing capacities in LAC. Currently, there is a limited number of global manufacturers able to supply all necessary reagents and/or starting materials (2) needed for manufacturing mRNA vaccines. To ensure sustainability and independence of vaccine production in the Region, access to reagents that are critical to the value chain is fundamental. Hence PAHO/WHO is launching a call for expression of interest to manufacturers in the Region of the Americas that wish to become part of a regional consortium that will ensure that mRNA vaccines can be sourced from starting materials and preparations (including seed lots, cell banks and intermediates) to the finished product.
Through this new initiative, PAHO and WHO will facilitate the establishment of a Regional consortium and support of a comprehensive technology transfer. Ideally, the group of manufacturers that come together for this initiative will include representatives from different geographical areas in the Americas and work towards an integrated regional value chain that will provide sustainability and ease the dependence on imported vaccines from outside the Region.
To support this activity, we are seeking expressions of interest from:
- Public or private manufactures of medical products (drugs, vaccines or drug substances) , and/or starting materials from the Region of the Americas, which could manufacture and supply one or more of the following:
- DNAse 1,
- T7 RNA Polymerase,
- RNase inhibitor,
- Guanyl Transferase,
- Pyrophosphatase,
- GTP,
- s-adenosyl methionine, and
- ribonucleotides.
Entities willing to be considered are invited to provide a brief summary that includes, at a minimum, the reagents and/or starting materials they wish to provide, a summary of their capacity, needs, and their interest in participating in this initiative.
Deadline submission
Deadline extension from 17 September to 15 October 2021
This information must be sent to:
MT@paho.org
(1). See Call for expression of interest to: Contribute to the establishment of a COVID-19 mRNA vaccine technology transfer hub (who.int)
(2). In accordance with WHO TRS Sixty-sixth report starting materials are: any substances of a defined quality used in the production of a pharmaceutical product but excluding packaging materials. In the context of biological products manufacturing, examples of starting materials may include cryo-protectants, feeder cells, reagents, growth media, buffers, serum, enzymes, cytokines, growth factors and amino acids.
OPAS seleciona centros na Argentina e no Brasil para desenvolver vacinas de mRNA contra COVID-19
Os selecionados foram o Instituto de Tecnologia em Imunobiológicos da Fundação Oswaldo Cruz (Bio-Manguinhos/Fiocruz) e a empresa biofarmacêutica Sinergium Biotech
Washington, DC, 21 de setembro de 2021 (OPAS) – A Organização Pan-Americana da Saúde (OPAS) anunciou a seleção de dois centros regionais para o desenvolvimento e produção de vacinas de mRNA na América Latina, na Argentina e no Brasil, a fim de enfrentar a COVID-19 e os futuros desafios de doenças infecciosas.
O Instituto de Tecnologia em Imunobiológicos da Fundação Oswaldo Cruz (Bio-Manguinhos/Fiocruz) foi selecionado como centro no Brasil. Este conta com uma longa trajetória na fabricação de vacinas e fez avanços promissores no desenvolvimento de uma vacina de mRNA inovadora contra a COVID-19.
A empresa biofarmacêutica privada Sinergium Biotech foi escolhida como centro na Argentina e fará parceria com a empresa de biotecnologia mAbxience – pertencente ao mesmo grupo – para desenvolver e fabricar os princípios ativos da vacina. Ambas as empresas têm ampla experiência na produção e desenvolvimento de imunizantes e outros produtos médicos biotecnológicos.
O anúncio foi feito por Soumya Swaminathan, cientista chefe da Organização Mundial da Saúde (OMS), e por Jarbas Barbosa, subdiretor da OPAS, durante um evento paralelo à 59ª reunião do Conselho Diretor da OPAS. O evento “Transferência de tecnologia para produção de vacinas de mRNA nas Américas” reuniu ministros da Saúde e autoridades dos países da região para discutir a produção de vacinas.
“Parabenizamos os dois centros selecionados”, afirmou Barbosa, acrescentando que “ainda há muito trabalho árduo pela frente, mas somos movidos pela convicção de que este esforço resultará em acesso oportuno e equitativo às vacinas em nossa região, que continua sendo a mais afetada por esta pandemia.”
A seleção é resultado de uma convocatória de manifestação de interesse promovida pela OMS em abril de 2021, na qual fabricantes e instituições de pesquisa públicas e privadas foram convidados a contribuir para o estabelecimento de centros de transferência de tecnologia para vacinas de mRNA contra a COVID-19 em economias emergentes. A iniciativa teve o apoio de parceiros globais da OPAS/OMS, como a Medicines Patent Pool.
A convocatória atraiu cerca de 30 manifestações de interesse de empresas e instituições científicas latino-americanas. Para garantir a sustentabilidade e aumentar ainda mais a capacidade regional, a OPAS lançou uma segunda chamada para manifestações de interesse em agosto de 2021. Esta convocação foi especialmente dirigida a fabricantes interessados em fazer parte de um consórcio regional para fornecer reagentes de grau farmacêutico e outros insumos para a produção de vacinas de mRNA.
A OPAS também apresentou recentemente a Plataforma Regional para o Avanço na Produção de Vacinas e outras Tecnologias de Saúde para COVID-19 nas Américas, que apoiará a colaboração entre países e agências para aplicar a capacidade de biomanufatura regional existente à produção de vacinas e outras tecnologias médicas. A plataforma se baseia no princípio de que a fabricação de produtos farmacêuticos deve ser regional e beneficiar todas as Américas. A distribuição das vacinas será realizada a todos os países pelo Fundo Rotatório da OPAS.
“Os atrasos na produção (de vacinas) fizeram com que muitos países (da região) continuassem esperando pelas doses que compraram meses atrás. A limitação no fornecimento de vacinas continua atrasando” a vacinação, disse a diretora da OPAS, Carissa F. Etienne, em seu discurso de abertura no evento. “Esta produção limitada e distribuição desigual de vacinas em face da assombrosa demanda dificultam nossa resposta à COVID-19 nas Américas. A vacinação em massa é fundamental” para controlar a pandemia, acrescentou.
Até o momento, as Américas foram a região mais atingida pela COVID-19 em todo o mundo, com 87,6 milhões de casos registrados e mais de 2,16 milhões de vidas perdidas. A distribuição da vacina continua desigual e poucos países da região alcançaram a meta de vacinação de 40% da população estabelecida pela OMS.
CONTATOS:
Sebastián Oliel: +1 202 316-5679
Ashley Baldwin: + 1 202 340-4025
Daniel Epstein: +1 301 219-2105
Nancy Nusser: + 410 934-9588
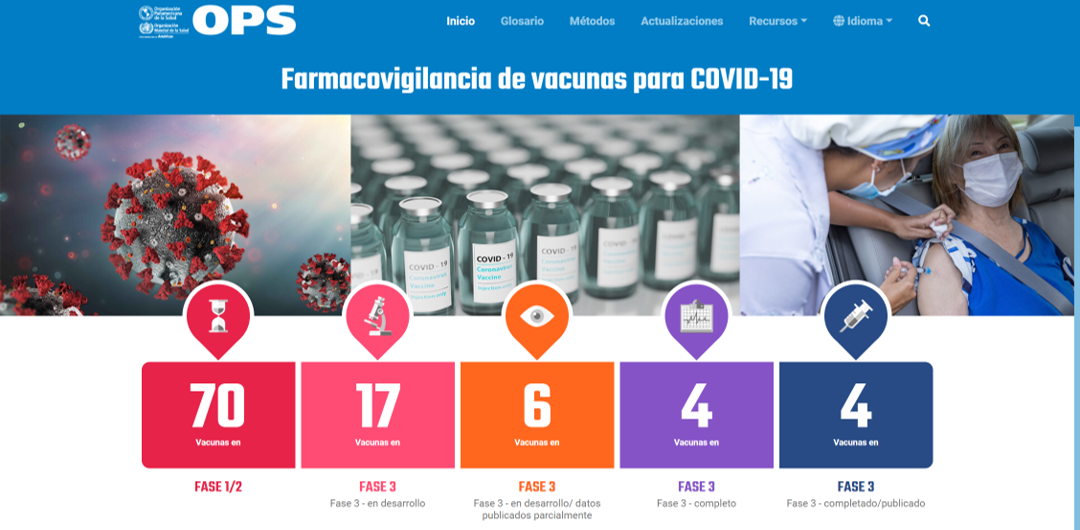
COVID-19 Vaccine Pharmacovigilance Dashboard
PAHO has launched a new platform to support regulatory processes for the introduction and the monitoring of COVID-19 vaccines safety, consolidating in a single tool information on the various components of the matter. New COVID-19 Vaccine Pharmacovigilance Dashboard is available in English and Spanish at: https://covid-19pharmacovigilance.paho.org/
CONVOCATÓRIA: Produção sustentável de vacinas mRNA contra COVID-19
Convocatoria de manifestaciones de interés para contribuir con la cadena de valor y el suministro de reactivos para la producción sostenible de vacunas basadas en ARNm contra la COVID-19 y contra otras enfermedades en la Región de las Américas
A fin de lograr el establecimiento satisfactorio de las capacidades de producción de vacunas en base a ARN mensajero (ARNm) en todo el mundo, la Organización Mundial de la Salud (OMS) ha puesto en marcha una nueva iniciativa para brindar apoyo a la transferencia de tecnología a fin de producir vacunas de ARNm en los países de ingresos bajos y medianos.(1) Esta iniciativa permitirá garantizar que todas las regiones de la OMS cuenten con la capacidad de producir vacunas como medida básica de preparación contra futuras amenazas infecciosas.
En el marco de esta iniciativa, la OMS y la Organización Panamericana de la Salud (OPS) están colaborando para establecer la capacidad de producción de vacunas en base a ARNm en América Latina y el Caribe. Actualmente, el número de productores mundiales con capacidad para suministrar todos los reactivos e insumos necesarios para producir vacunas de ARNm es limitado. (2) Para garantizar la sostenibilidad y la independencia en la producción de vacunas en la Región, es imperativo tener acceso a los reactivos fundamentales en la cadena de valor. Por consiguiente, la OPS/OMS está haciendo una convocatoria de manifestaciones de interés para los productores de la Región de las Américas que deseen formar parte de un consorcio regional que garantice la provisión de todos los insumos necesarios para las vacunas de ARNm, desde materiales de partida y preparaciones (incluidos lotes de siembra, bancos de células y productos intermedios) hasta el producto terminado.
Por medio de esta nueva iniciativa, la OPS y la OMS facilitarán el establecimiento de un consorcio regional y brindarán apoyo a la transferencia integral de tecnología. Idealmente, en esta iniciativa participarán representantes de diferentes zonas geográficas de la Región de las Américas que trabajarán en conjunto con el fin de establecer una cadena de valor integrada a nivel regional que brindará sostenibilidad y aliviará la dependencia de las vacunas procedentes de fuera de la Región.
En apoyo de esta actividad, solicitamos manifestaciones de interés de:
- fabricantes del sector público o del sector privado de productos médicos (medicamentos, vacunas o sustancias farmacológicas) o de materiales de partida de la Región de las Américas, que puedan producir y suministrar uno o varios de los siguientes insumos:
- ADNasa 1,
- ARN polimerasa T7,
- inhibidor de la ARNasa
- guanililtransferasa,
- pirofosfatasa,
- GTP,
- S-adenosilmetionina, y
- ribonucleótidos.
Se invita a las entidades que deseen ser consideradas a presentar un breve resumen que incluya, como mínimo, los reactivos o materiales de partida que deseen proporcionar, un resumen de su capacidad, sus necesidades y su interés en interés en participar en esta iniciativa.
Fecha límite para la presentación: 17 de septiembre del 2021
Esta información debe enviarse a: MT@paho.org
(1).Véase la convocatoria [en inglés] a presentar manifestaciones de interés para contribuir al establecimiento de un núcleo de transferencia de tecnologías de producción de vacunas contra la COVID-19 basadas en ARNm (https://www.who.int/news-room/articles-detail/call-for-expression-of-in…).
(2). De conformidad con la Serie de Informes Técnicos no 76, los materiales de partida son cualquier sustancia de determinada calidad que se utiliza para elaborar un producto farmacéutico, con la excepción de los materiales de embalaje. En el contexto de los productos biológicos, algunos ejemplos de materiales de partida son los crioprotectores, las células sustentadoras, los reactivos, los medios de cultivo, los tampones, los sueros, las enzimas, las citoquinas, los factores de crecimiento y los aminoácidos.
Fuente: OPS
ANMAT se torna membro observador do IMDRF
Em deicisão unânime do Comitê Diretivo, a ANMAT se tornou membro observador oficial do Fórum Internacional de Reguladores de Dispositivos Médicos (IMDRF)
A matéria completa está disponível no webiste da ANMAT: https://www.argentina.gob.ar/noticias/anmat-se-convierte-en-observador-oficial-de-imdrf
Recomendações sobre processos regulatórios e aspectos relacionados à introdução de vacinas durante a pandemia Covid-19 e outras emergências
Esta nota está disponível em inglês
The document “Recommendations on Regulatory Processes and Aspects related to the Introduction of Vaccines during the COVID-19 Pandemic and Other Emergencies” is now published in IRIS at https://iris.paho.org/handle/10665.2/54516 .
The objective of this document is to identify the main gaps in readiness for the introduction of COVID-19 vaccines and to propose the regulatory procedures needed to manage and reduce these gaps, which were detected through a situation analysis of the emergency regulatory procedures implemented by national regulatory authorities (NRAs) in the Americas and based on the available information regarding existing regulatory frameworks in the Region. During emergency situations, the World Health Organization (WHO) recommends that NRAs adopt agile and efficient regulatory pathways to evaluate the quality, safety, and efficacy of new vaccines, which should be based on risk-benefit assessments. It also recommends that, for each authorized vaccine, pharmacovigilance activities should be implemented, based on risk management plans. Countries should have national emergency preparedness and response plans that include streamlined regulatory pathways that allow new vaccines to be introduced following legal and orderly processes. This regulatory preparedness is key to achieving a rapid response that does not obstruct or delay the availability of vaccines.